Comment la surveillance du diaphragme peut vous aider à améliorer la ventilation mécanique
L’assistance respiratoire peut sauver des vies en réanimation, mais si elle n’est pas correctement dosée, elle augmente aussi le risque de provoquer des effets indésirables.[1],[2] C’est dans cette optique que la surveillance du diaphragme trouve tout son sens car il s’agit d’un marqueur de résultats comme la mortalité hospitalière et le sevrage prolongé. En outre, elle peut vous aider à prendre des décisions thérapeutiques plus éclairées tout au long du traitement respiratoire.
L’impact clinique d’une lésion du diaphragme
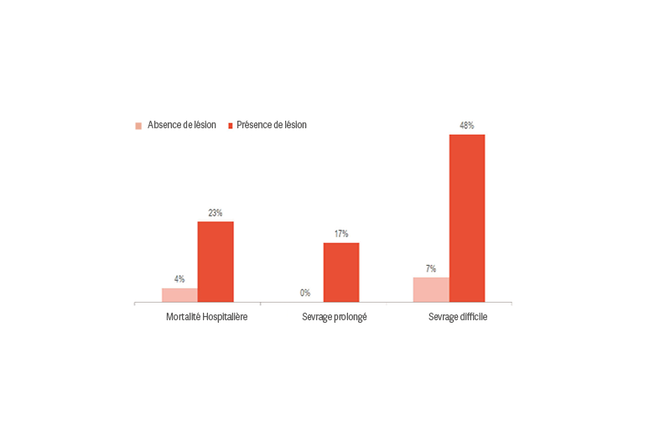
Une lésion du diaphragme augmente de manière significative le risque d’obtenir de moins bons résultats, comme un sevrage difficile ou prolongé et une mortalité à l’hôpital.[1] ,[2] De plus, 23 à 84 % des patients présentent une lésion importante du diaphragme au premier test de respiration spontanée.[3] Une étude a montré que les patients qui présentaient une lésion du diaphragme avaient été ventilés en moyenne 576 heures contre 203 heures pour ceux qui n’en présentaient pas.[4]
Deux facteurs sont considérés à l’origine de ce phénomène.[1] Dans certains cas, les patients font trop d’efforts pour respirer, ce qui mène à l’épaississement du diaphragme. Dans d’autres cas, les patients ne travaillent pas assez du fait d’une assistance excessive et/ou une ventilation contrôlée au début de leur traitement, ce qui entraîne une atrophie. Dans les deux cas, les résultats sont impactés négativement, et la principale difficulté pour les cliniciens à l’heure actuelle est l’incapacité des ventilateurs les plus courants à fournir des outils diagnostiques qui reflètent ces informations.
Pourquoi les outils diagnostiques des ventilateurs actuels ne suffisent pas
Les courbes du ventilateur sont utilisées pour interpréter les besoins respiratoires du patient, mais leur principale fonction est de montrer ce que l’appareil délivre au patient. Il est alors plus difficile de détecter l’asynchronisme, la sur-sédation, l’assistance excessive ou insuffisante lors de la respiration spontanée.
Par exemple, seuls 21 % des cliniciens détectent l’asynchronisme sous la forme d’efforts inspiratoires non récompensés.[5] De plus, un patient en aide inspiratoire peut sembler respirer spontanément, alors qu’il ne déclenche en fait aucune respiration spontanée.[5], [6]
Il est ainsi difficile de quantifier les efforts fournis par le patient pour respirer et de savoir dans quelle mesure il ou elle risque une lésion du diaphragme.
Comment surveiller le diaphragme
Afin d’essayer de protéger le diaphragme, vous devez donc évaluer le risque de lésion potentielle et surveiller son activité en continu.
Un examen échographique vous permet d’évaluer le dysfonctionnement du diaphragme en mesurant son épaisseur et l’évolution de celle-ci dans le temps. Les avancées récentes dans le domaine de l’échographie permettent aux cliniciens d’évaluer plus facilement le fonctionnement du diaphragme pour éventuellement le protéger au cours de la ventilation mécanique.[7]
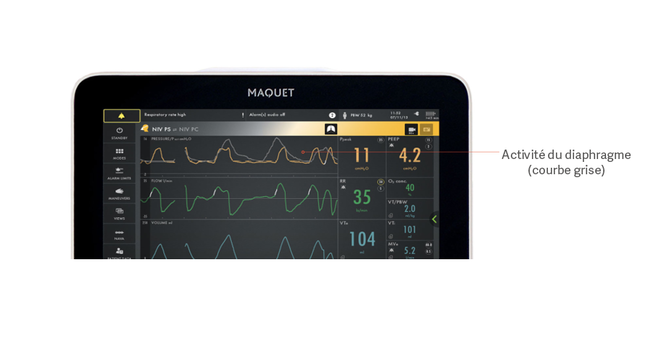
Pour une surveillance continue du fonctionnement du diaphragme, respiration par respiration, il est possible de monitorer son activité électrique (Edi). Il s’agit d’un outil diagnostique au chevet du patient obtenu grâce à une sonde d’alimentation spécialement conçue à cet effet. L’activité électrique s’affiche sous forme de courbe en dessous des courbes classiques de pression/débit du patient, et montre la présence ou l’absence de respiration spontanée ainsi que son amplitude.
La surveillance de l'activité électrique du diaphragme (Edi) peut vous aider à comprendre les efforts respiratoires, à détecter un asynchronisme et à évaluer dans quelle mesure une assistance excessive ou insuffisante ainsi que la sédation affectent la capacité respiratoire.[8],[9] Vous pouvez également évaluer l’évolution des efforts respiratoires suite à une intervention. Par exemple, lorsque vous changez le patient de position, lui administrez des médicaments comme du salbutamol ou, plus important encore, lorsque vous réduisez l’assistance respiratoire au cours du sevrage.
Une combinaison d’examens échographiques et de surveillance continue de l’activité du diaphragme (Edi) peut se révéler nécessaire pour obtenir une vue d’ensemble complète.
Comment la surveillance du diaphragme peut aider à protéger le patient et à simplifier son sevrage
Pour éviter les lésions pulmonaires induites par la ventilation, il vaut mieux éviter la ventilation invasive, l’asynchronisme, la sur- ou la sous-assistance ainsi que les longues périodes de sédation et d’inactivité du diaphragme. Un patient qui « lutte » contre le ventilateur est souvent perdant. Une telle situation conduit généralement à l’augmentation de la sédation, à une ventilation prolongée et parfois à l’intubation.
La surveillance du diaphragme peut permettre de relever ces défis.[10],[11],[12] Elle vous aide à identifier les efforts effectués par le patient, respiration par respiration. Vous pourrez également voir si le ventilateur réagit à temps, en fournissant une assistance suffisante sans être excessive, car vous aurez à votre disposition une valeur physiologique objective pour vous guider.
En traitement non invasif, elle pourra vous aider à adapter la durée de ventilation et l’assistance nécessaire, ce qui peut réduire la nécessité d’intuber. Une bonne interaction patient-ventilateur est l’un des facteurs clés d’une VNI réussie.[13]
Cette surveillance continue est également un indicateur en temps réel de l’effort respiratoire fourni par le patient qui peut vous aider à évaluer le moment où l’intubation est vraiment nécessaire. Elle peut même vous aider à optimiser la durée des tests de respiration spontanée et à faire en sorte qu’ils réussissent plus et plus souvent.
Comment la surveillance du diaphragme peut aider à diminuer la durée de la ventilation
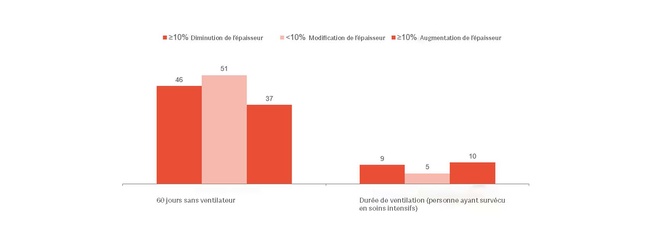
E. C. Goligher a montré qu’une évolution précoce de l’épaisseur du diaphragme était un indicateur de la durée du séjour en réanimation et d’autres complications comme la réintubation, la trachéotomie, la prolongation de la ventilation mécanique et la mortalité.[1] Cela semble indiquer qu’un épaississement du diaphragme qui se maintient entre 10 et 20 % correspondrait à une situation optimale. Ainsi, cet épaississement vous donne des indications concernant les risques auxquels le patient est exposé et vous permet d’optimiser le traitement. Des essais cliniques randomisés sont nécessaires pour comprendre si, en évitant une lésion du diaphragme, il est également possible de réduire les complications.
On retrouve cependant les mêmes résultats que ceux de la figure ci-dessus avec l’expérience clinique d’un hôpital londonien qui indiquait une diminution significative de la durée de la ventilation mécanique lorsque l’activité du diaphragme était surveillée.[14] Le groupe dont l’activité du diaphragme n’avait pas été surveillée passait en moyenne 12 jours sous ventilation mécanique contre en moyenne 9 jours pour le groupe dont cette activité était surveillée (103 patients sur 493).
Surveiller le diaphragme peut également vous aider à détecter des complications, comme un syndrome congénital d’hypoventilation alvéolaire centrale ou une lésion du nerf phrénique.[15],[16]
Comment la surveillance du diaphragme peut vous aider à prendre des décisions thérapeutiques plus éclairées
Surveiller l’activité du diaphragme peut vous aider à prendre des décisions plus éclairées pour votre patient tout au long du traitement et vous fournit de précieuses informations à plusieurs moments cruciaux.
Surveiller et identifier les efforts respiratoires
De récents rapports indiquent que la surveillance de l’activité électrique du diaphragme permet de contrôler l’effort respiratoire et l’interaction patient-ventilateur.[18]
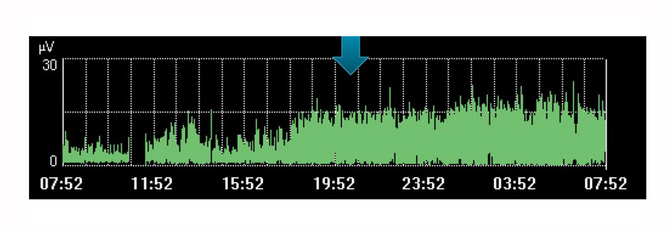
Bien sûr, la surveillance de l’activité électrique du diaphragme possède ses limites en tant que valeur isolée unique. À l’instar d’autres variables physiologiques, elle doit être envisagée en association avec d’autres mesures ainsi que dans le contexte de l’évolution du traitement ; une tendance dans le temps qui peut vous aider à déterminer si votre patient évolue dans la direction souhaitée.
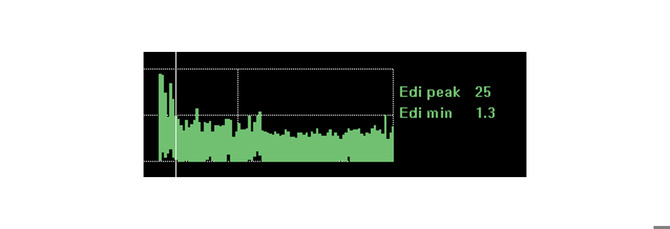
L’image ci-dessus montre, par exemple, une augmentation de l’effort du diaphragme au cours d’une période qui avait été envisagée par le médecin comme un temps de repos pour le patient. La tendance indique que le diaphragme ne s’est pas reposé, compte tenu de l’augmentation de l’effort fourni par le patient au cours de cette période.
Identifier une assistance excessive ou insuffisante
Pour éviter toute lésion du diaphragme chez le patient, il doit être sollicité de façon appropriée. Cette sollicitation appropriée est difficile à déterminer sans surveillance du diaphragme.
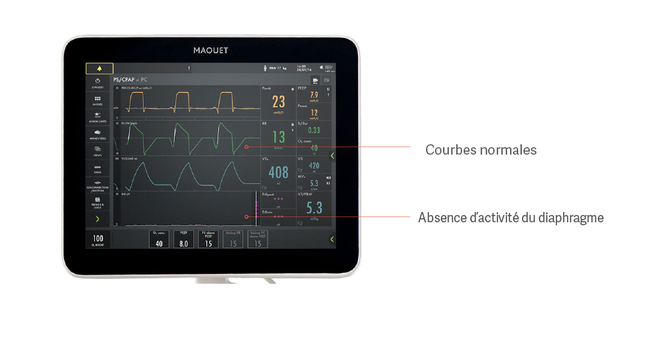
Par exemple, un patient peut sembler respirer spontanément en aide inspiratoire sans pour autant utiliser son diaphragme, comme le montre l’image ci-dessus. Voici un exemple de la façon dont une assistance excessive empêche le bon fonctionnement du diaphragme et entraîne son atrophie. Les courbes de pression, de débit et de volume semblent normales, mais le signal Edi violet, situé en bas, est plat, ce qui indique un diaphragme inactif.
Un autre exemple est la sous-assistance, qui est l’inverse de l’assistance excessive et tout aussi mauvaise pour le patient. Un patient pour lequel l’aide est insuffisante fait trop d’efforts pour respirer, ce qui entraîne l’épaississement du diaphragme. Cet effort est peut-être plus facile à observer chez le patient, mais sans aucune valeur objective affichée sur le ventilateur, il est difficile de l’identifier formellement.
Les deux exemples de lésions au diaphragme (atrophie et épaississement) sont fréquemment observés chez les patients et associés à une aggravation des résultats cliniques.[1]
Identifier l’asynchronisme entre le patient et le ventilateur
L’asynchronisme est associé à des résultats cliniques médiocres pendant la ventilation mécanique.[18] Dans une étude récente, seuls 21 % des cliniciens ont réussi à détecter l’asynchronisme sous la forme d’efforts inspiratoires non récompensés.[5] De nombreux autres types d’asynchronismes passent cependant inaperçues : des efforts inefficaces ou excessifs, un effort inspiratoire retardé, un arrêt retardé du cycle, un double déclenchement et un auto-déclenchement.
L’image montre l’activité électrique du diaphragme (en gris) superposée à la courbe de pression (en jaune), ce qui permet de voir facilement les différences entre les besoins du patient et l’apport du ventilateur.
Déterminer un mode de ventilation
Votre objectif est le suivant : votre patient doit conserver un effort respiratoire optimal qui ne soit ni insuffisant, ni excessif.[1] En surveillant constamment l’activité du diaphragme, vous cernerez mieux l’effort fourni ou non par le patient. Si l’activité du diaphragme est élevée et qu’elle augmente, il vous faudra peut-être augmenter le niveau d’assistance.[19],[20],[21]
Si l’activité est faible ou qu’elle diminue, vous pouvez réduire le niveau d’assistance.[19] Il est également important de surveiller les autres paramètres de diagnostic associés à la ventilation avant de modifier l’assistance. La recherche se développe dans ce domaine. À l’avenir, des connaissances approfondies au sujet des paramètres du diaphragme pourraient encore améliorer l’évaluation.[22]
Définir une PEP (Pression Expiratoire Positive) optimale
Il n’existe aucune procédure standardisée pour régler la PEP d’un patient au cours de la respiration spontanée. Pourtant, une PEP bien réglée peut réduire les atélectasies, les ouvertures et fermetures cycliques des voies aériennes et protéger les alvéoles. La mécanique pulmonaire et l’oxygénation s’améliorent alors à leur tour.
Le titrage de la PEP, avec la surveillance du diaphragme, ont montré des résultats probants chez les nouveau-nés, en leur permettant de se détendre correctement entre chaque respiration et en empêchant le dérecrutement des poumons.[12]
Chez les patients adultes, Passath a utilisé le monitorage du diaphragme et de l’oxygénation pendant les variations de la PEP pour identifier le niveau de PEP auquel a lieu une respiration courante avec un effort minimal.[23] Une diminution excessive de la PEP a entraîné une augmentation de l’effort respiratoire de 50 à 60 % qui, combinée à la détérioration de l’oxygénation, suggérait également un dérecrutement pulmonaire partiel.
Optimiser la gestion de la sédation
Le monitorage de l’activité du diaphragme, en relation avec la sédation, a pour avantage de permettre d’essayer de maintenir le diaphragme actif autant que possible.[1] Surveillez simplement l’activité du diaphragme de votre patient et sa réaction à la ventilation pour trouver un niveau de sédation adéquat avec une activité du diaphragme maintenue.
Une certaine formation peut être nécessaire pour différencier l’effet de la sédation d’autres facteurs physiologiques susceptibles d’avoir également un impact sur le fonctionnement du diaphragme. Toutefois, l’Edi est particulièrement efficace pendant les périodes de maintien de la sédation, car vous pouvez voir en permanence l’évolution de l’effort fourni par le patient.
Surveiller et identifier l’impact des interventions, du repos et de la rééducation
Le monitorage de l’activité du diaphragme offre une garantie supplémentaire que le patient peut supporter les changements auxquels vous le soumettez. L’activité diaphragmatique est modifiée par une série de changements physiologiques tels que le repos, la position assise, la marche, le traitement à la caféine et même la rééducation générale et la guérison.
Si le patient supporte bien ces changements, l’activité du diaphragme ne variera presque pas. Une aggravation de la situation clinique et la nécessité de fournir un effort respiratoire plus important augmenteront quant à eux l’activité diaphragmatique. Une position de repos améliorée réduira l’activité du diaphragme nécessaire pour générer les respirations.
L’image montre l’activité continue du diaphragme d’un patient qui était sur le point d’être intubé en raison d’une détresse respiratoire aiguë causée par une pneumonie. En surveillant l’activité du diaphragme, le clinicien est parvenu à optimiser l’assistance et à inverser la situation.
Monitorer et surveiller le sevrage
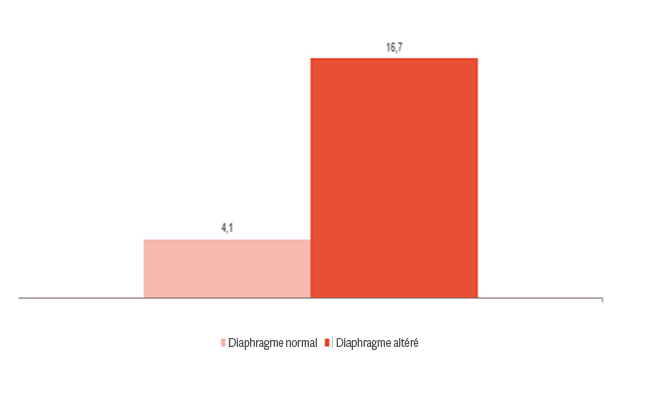
Comme le montre l’image, le dysfonctionnement du diaphragme est fortement lié aux difficultés de sevrage.[4] Le monitorage de l’activité du diaphragme peut vous aider à prédire l’état de préparation au sevrage et à surveiller sa progression [24],[25],[26] : de la ventilation invasive et non invasive, de la thérapie à haut débit et lorsque toute l’assistance a été retirée.
Il est possible de monitorer la capacité de votre patient à bien supporter la diminution de l’assistance sur plusieurs minutes et, ce qui peut vous aider à poursuivre cette diminution ou à l’affiner. Il peut être nécessaire de revenir à vos réglages précédents pour éviter une rechute de votre patient et les complications qui y sont souvent liées.
Mentions légales
Cathéter Edi - Sonde d'alimentation entérale à usage unique équipée d'électrodes de mesure destinée à recueillir l'électromyogramme du diaphragme et disponible sur certains systèmes d'assistance respiratoire MAQUET. Ce cathéter permet au mode NAVA d'offrir une assistance respiratoire proportionnelle et synchronisée au signal lié à l'activité électrique du diaphragme. Il s'agit d'un dispositif médical de classe IIa, CE0123. Produit fabriqué par MAQUET CRITICAL CARE AB, Suède. Pour un bon usage, veuillez lire attentivement toutes les instructions figurant dans la notice d’utilisation du produit.
PUB-2023-0375-A, version de mai 2023
